Los enlaces quimicos : son las fuerzas que mantienen unidos a los atomos.
Cuando los átomos se enlazan entre si, ceden aceptan o comparten electrones. Son los electrones de valencia quienes determinan de que forma se unirá un atomo con otro y las caracteristicas del enlace.
Enlaces Ionicos:Este enlace se produce cuando átomos de elementos metálicos
(especialmente los situados más a la izquierda en la tabla periódica
-períodos 1, 2 y 3) se encuentran con átomos no metálicos
(los elementos situados a la derecha en la tabla periódica -especialmente
los períodos 16 y 17.
En este caso los átomos del metal ceden electrones a los átomos
del no metal, transformándose en iones positivos y negativos,
respectivamente. Al formarse iones de carga opuesta éstos se atraen
por fuerzas eléctricas intensas, quedando fuertemente unidos y dando
lugar a un compuesto iónico. Estas fuerzas eléctricas las
llamamos enlaces iónicos.
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio En la siguiente simulación interactiva están representados
los átomos de sodio y cloro con solo sus capas externas de electrones.
Enlaces Covalentes:Los enlaces covalentes son las fuerzas que mantienen unidos entre sí
los átomos no metálicos (los elementos situados a la
derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo
(electrones de valencia) y tienen tendencia a ganar electrones más
que a cederlos, para adquirir la estabilidad de la estructura electrónica
de gas noble. Por tanto, los átomos no metálicos no pueden
cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones
entre los dos átomos, uno procedente de cada átomo. El par
de electrones compartido es común a los dos átomos y los mantiene
unidos, de manera que ambos adquieren la estructura electrónica de
gas noble. Se forman así habitualmente moléculas: pequeños
grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las
que dos átomos de cloro se hallan unidos por un enlace covalente.

Enlace covalente polar : Es cuando en un enlace, uno de los átomos ejerce una atracción mayor
sobre los electrones de enlace que el otro. Depende de la
electronegatividad de los átomos que se enlazan.Cuando la diferencia de
electronegatividad entre los átomos de enlace está entre 0.5 y 2.0, la
desigualdad con que se comparten los electrones no es tan grande como
para que se produzca unatransferencia completa de electrones; el átomo
menos electronegativo aún tiene cierta atracción por los electrones
compartidos.
Se llaman polares porque al compartir desigualmente los electrones se generandos polos a través del
enlace; un enlace covalente polar tiene polos positivo y negativo
separados. El polo negativo está centrado sobre el átomo más
electronegativo del enlace y el polo positivo estácentrado sobre el
átomo menos electronegativo del enlace.
Enlace cobalente no polar: Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia
de electronegatividad es cero, entoncesse forma un enlace covalente no polar.
El enlace covalente no polar se presenta entre átomos del mismo
elemento o entre átomos con muy poca diferencia de electronegatividad.
Un ejemplo es la moléculade hidrógeno, la cual está formada por dos
átomos del mismo elemento, por lo que su diferencia es cero. Otro
ejemplo, pero con átomos diferentes, es el metano. La electronegatividad
del carbono es 2.5y la del hidrógeno es 2.1; la diferencia entre ellos
es de 0.4 (menor de 0.5), por lo que el enlace se considera no polar.
Además el metano es una molécula muy simétrica, por lo que las
pequeñasdiferencias de electronegatividad en sus cuatro enlaces se
anulan entre sí.
Enlace covalente simple : Cada átomo
aporta un electrón al enlace, es decir, se
comparte un par de electrones entre dos átomos. Un ejemplo es
la molécula de Hidrógeno (H2):
Si los átomos están infinitamente separados, se considera que tienen
energía cero, pero a medida que se acercan existen fuerzas de
atracción (entre
el e‑ de un átomo y el p+ del otro), y fuerzas
de repulsión, (entre las dos nubes electrónicas). Al principio las
fuerzas de atracción son superiores a las de repulsión por lo que al
acercarse se libera energía, pero llega un momento en el que las
repulsiones empiezan a tener importancia y cuesta cada vez más
acercarlos. Es decir, que la curva pasa por un mínimo y la distancia a
la que se produce es la distancia de enlace que para la molécula de H2
es de 0'74 Aº.
La
molécula de Hidrógeno presenta una energía menor a la de los átomos
separados (que es una condición indispensable para que exista enlace).
En este caso los dos átomos de Hidrógeno adquieren configuración
electrónica de gas noble.
Enlace Covante doble: Cada átomo
aporta dos electrones al enlace, es decir, se
comparten dos pares de electrones entre dos átomos. Un ejemplo
es la molécula de Oxígeno (O2):
Enlace covalente triple: Cada átomo
aporta tres electrones al enlace, es decir, se
comparten tres pares de electrones entre dos átomos, por
ejemplo, la molécula de Nitrógeno (N2).

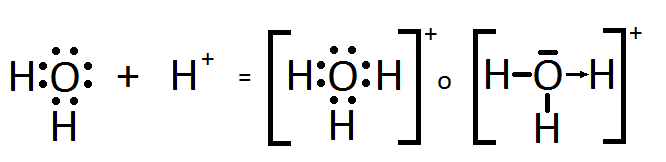
Enlace covalente cordinado: enlace covalente en el que cada par de electrones compartido por dos átomos es aportado por uno de ellos. El átomo que aporta el par de electrones se denomina dador, y el que lo recibe, receptor. Típicamente un enlace de coordinación se forma cuando una base de Lewis dona un par de electrones a un ácido de Lewis. Esta descripción de enlace es característica de la teoria de enlace de valencia y no tiene cabida en la teoria de orbitales moleculares o en la del campo de ligandoas .